Em 2020, a indústria alemã de tecnologia médica gerou vendas de € 30,3 bilhões*3 com seus produtos enquanto a indústria Europeia fez aproximadamente € 135 bilhões.
Muito já foi escrito sobre a transição da Diretiva de Dispositivos Médicos (MDD) para o Regulamento de Dispositivos Médicos (MDR) no que se refere á aprovação de produtos médicos. Devido a este tópico, muitos artigos tratam das implicações regulatórias. Neste artigo, gostaríamos de nos concentrar na implementação e nas consequências financeiras da introdução de MDR para as empresas.
A introdução da MDR – Qual é a posição da indústria?
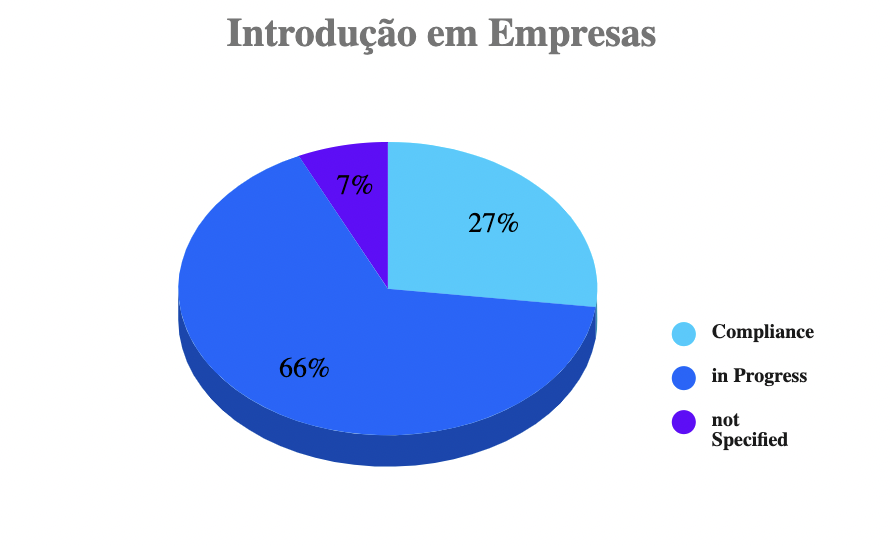
De acordo com um levantamento*1 em maio de 2020, no momento da ativação inicial da MDR, apenas 27% das empresas deveriam já ter implementado a MDR na prática operacional. 66% das empresas disseram que ainda tinham que desenvolver uma estratégia para garantir o cumprimento dos regulamentos exigidos pela MDR. O tamanho da empresa desempenha aqui um papel importante: apenas 24% das empresas com vendas de menos de 85 milhões de euros disseram que poderiam alcançar a meta dentro do prazo estipulado, em comparação com 34% das empresas maiores – ou seja, mais de 50% das maiores firmas são mais bem sucedidas na implementação da regulamentação imposta pela MDR.
Esta é uma prévia do que está por vir. É óbvio que empresas maiores podem arcar mais facilmente com as consequências da regulamentação imposta pela MDR, ou seja, a carga de trabalho e custos associados, do que as empresas menores.
Com o adiamento da obrigação da MDR por 1 ano para 26 de maio de 2021*2, uma enorme pressão foi aliviada no mercado. Mas o silêncio é enganador. A necessidade de reavaliar portfólios de produtos e os custos associados à aprovação de novos produtos permanece, e com ela permanecem também decisões difíceis sobre a rentabilidade dos futuros investimentos no portfólio de produtos e sua estrutura.
Produtos antigos – autorizados em uma época em que os Órgāos Notificados ainda estavam despreocupados com o assunto – colocarão problemas com a sua documentação perante os Órgāos Notificados, dos quais apenas metade é re-acreditada com cerca de 20 designações. Esta é uma das razões da introdução.
A introdução do MDR – Quanto nos custará?
De acordo com um relatório da Ernst & Young*4, o custo da introdução de MDR para a indústria europeia é:
- €7,5 mil milhões para cumprimento do Sistema Identificador Único de Dispositivos
- €17,5 mil milhões de euros para uma autorização centralizada do pré-mercado
Estes são custos de € 25 bilhões em toda a Europa, dos quais a quota da Alemanha será de € 5,6 bilhões. Isso representa 18,5% das vendas anuais e bem acima da rentabilidade média das empresas alemãs, cujo EBIT foi de 8,1% em 2019 de acordo com um estudo da Fundação Hans Böckler*5, que representa dois terços das empresas alemãs de tecnologia médica.

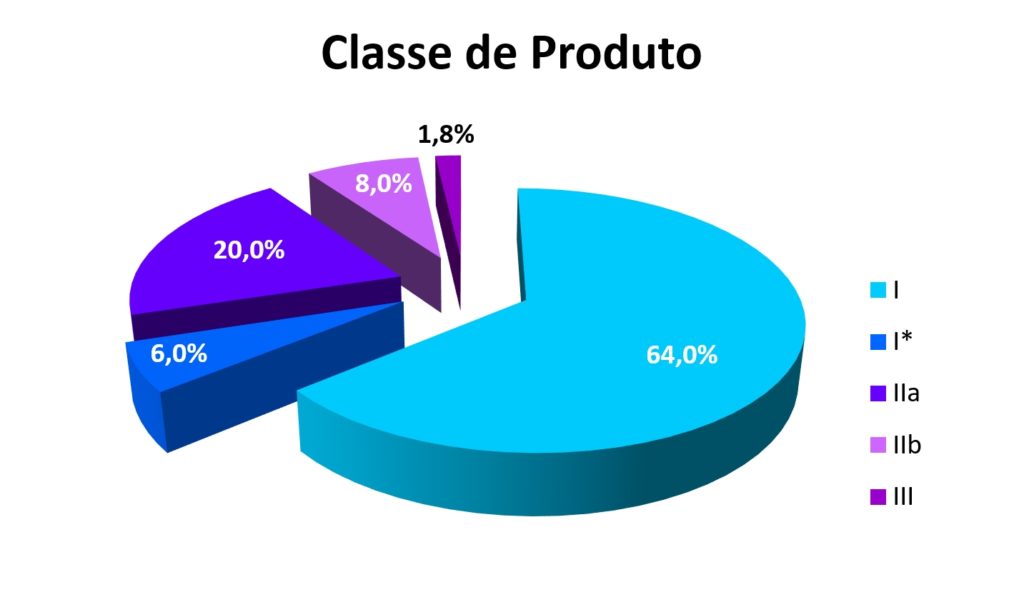
Estes números podem ser surpreendentes, mas o mesmo estudo*4 cita 17,5 milhões de euros em custos para a aprovação de um único produto da Classe III – através de um ensaio clínico, que, no entanto, representa apenas 1,8% das autorizações*6. 8% para os produtos da Classe II-B e 20% para os produtos da Classe II-A, sendo que estes dois últimos exigem uma analise complexa com base em avaliação clínica ou em dados clínicos existentes. Dos 500.000 produtos atualmente produzidos na Alemanha*3, isso afeta cerca de 150.000.
Isto torna claro que os custos da mudança para MDR terão consequências dolorosas para o resultado, mesmo sendo distribuídos por vários – no máximo quatro – anos. Na melhor das hipóteses, o custo é 57% dos lucros de uma empresa – durante quatro anos.
Agir, não reagir!
Pelas razões acima expostas, a aprovação produtos antigos não está aberta a discussão, então as empresas se deparam com uma escolha:
- Abandono de produtos antigos e, se necessário, de linhas inteiras de produtos
- Substitua-os por produtos novos e inovadores
- Retirar-se do negócio lucrativamente
O ponto 2 torna necessário encontrar uma alavanca de valor estratégico da inovação, garanti-la com patentes e implementá-la. Isso também pode ser feito com apoio externo, ou seja, encontrar o parceiro certo ou se preparar para assumir uma unidade de negócios.
O ponto 3 exige que se encontre um provável comprador e que se prepare para apresentar uma unidade de negócio ou a empresa em sua totalidade.
Quanto mais cedo isso acontecer, melhor, porque o espaço de manobra torna-se mais estreito!
Referências:
- Survey from the Regulatory Affairs Professionals Society (RAPS) and KPMG, Sept. 2019
- Regulation (EU) 2020/561 of the European Parliament and of the Council of 23 April 2020
- „BVMed Branchenbericht 2020“
- EY, “How the new EU Medical Device Regulation will disrupt and transform the industry“, 2016
- Hans Böckler Stiftung, „Branchenanalyse Medizintechnik“, Mai 2020
- BVMed 42 / 2017
